明天就要AP考试了,作为化学部分,大家是否做好准备了呢?老师为大家整理了最新的AP化学知识重难点,在考试前夕,为大家进行详细的讲解。下面让我们一起来看看吧!
Part III:Equlibrium.平衡整章的难点在于对平衡点建立的理解。
平衡是在一个相对稳定的环境中建立的,一旦外界的环境条件改变,平衡将会被打破从而移动并寻找新的平衡点,可以说一个可逆反应永远都是在平衡点或在找平衡点的路上。由此引出的平衡移动方向问题则是AP考察的重点,此处应该清楚equlibrium constant(Keq)和reaction quotient(Q)的定义、表达式书写和联系。可以说equlibrium constant是一个特殊的reaction quotient,因为后者任何反应时间点都可以计算得到,而前者是平衡点时才唯一确定下来,因此所有的平衡移动都可以看作Q在某一刻不再等于Keq而需要向Keq靠近时体系中各个物种的浓度做出的调整。因此当已知K和体系中各个物种分浓度时可以通过计算Q并和K的比较来判断平衡的移动方向。
i)溶解平衡:溶解平衡中常考题型是判断体系中是否有沉淀产生,已知Ksp时计算溶液中离子浓度及大小比较,共离子效应造成的溶解度的减小,选择特定外部条件来增加溶解度等。
此类问题依然是根据反应商判断平衡的方向问题,需要强调的一点是molar solubility即饱和溶液中(此时溶解和结晶速率相等,达到平衡)溶解的那部分solute的molar concentration,计算过程中务必看清这一点。

ii)酸碱平衡:酸碱平衡部分主要对应缓冲溶液(buffer)考点。
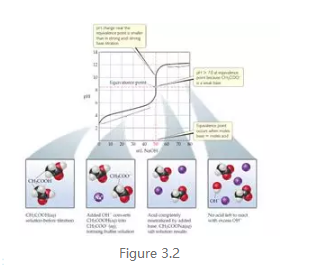
事实上AP更多的考察套路是在一个滴定过程中形成缓冲溶液,然后做相关计算和解析。那么在滴定过程中每一个特征点的物种组成,相应的变化以及对应的溶液pH计算都是需要掌握的。以NaOH滴入CH3COOH为例,在initial(NaOH加入的体积为0)时,溶液中此时只有CH3COOH的独自默默地解离(dissociate,要注意和dissolve的区别),pH的计算是常规的弱酸计算方法,当NaOH缓慢加入,一部分CH3COOH被中和变成CH3COO-,它和CH3COOH共存在溶液中,此时便形成了buffer,一直到equivalence point最后一个OH-离子加进来中和完所有的CH3COOH之前都是buffer,这个区域的pH可由buffer的pH公式计算,该段对应的滴定曲线会有先急再缓最后急的趋势,在刚好原来一半的CH3COOH被中和变成CH3COO-时,溶液中此时剩余CH3COOH被中和变成CH3COO-相等,属于buffer的most effective的点,滴定过程中叫half way point(half equivalence point),此时pH为该酸的Pka,曲线上处于最平缓的点(slope最接近0)。在equivalence point时考察溶液中剩余物种,只有CH3COONa,该盐在此处发生hydrolysis,即weak acid CH3COOH的conjugate base CH3COO-与水的解离反应,此时的pH的计算是常规的弱碱的计算方法,要注意的是此时的ICE chart里面initial concentration需要重新计算(CH3COO-的摩尔数比酸碱的体积之和)。
来源:葛艳丽 北京新东方北美留学
以上就为大家整理的“2018年5月8日AP化学重难点考前点题三”,更多精彩内容,请关注新东方在线GMAT频道。